Орфанные заболевания встречаются очень редко. Даже само их название происходит от английского слова, обозначающего беспризорного сироту (orphan), так как люди, страдающие ими, чувствуют себя заброшенными и отринутыми системой здравоохранения. Им сложно поставить диагноз, так как он нетипичен. Для их лечения часто нет устоявшегося протокола и действенных препаратов. И каждый такой случай превращается в настоящую медицинскую загадку. Об одной из них мы сегодня и расскажем вместе с Takeda Pharmaceutical.
Парочка в Принстоне
Пара молодоженов счастливо обедает в ресторане. Внезапно у новобрачной резко опухает лицо и горло, она начинает задыхаться, и муж — молодой белый мужчина — в ужасе вызывает скорую. Врачи диагностируют анафилактический шок и доставляют двадцатилетнюю темнокожую девушку в одну ничем не примечательную больницу в Принстоне, штат Нью-Джерси (США). Увы, но мулатке становится все хуже и хуже. Помимо трудностей с дыханием у нее появляются сильные боли и резь в животе. Однако все тесты на аллергию отрицательные, хотя антигистаминные препараты дают кратковременный положительный эффект.
К делу подключается известная команда диагностов. Их первое подозрение — беременность. Затем сальмонеллез. Позже — анафилактический шок из-за физических нагрузок. Пациентку заставляют пройти стресс-тест на беговой дорожке, но, кроме усиления болей в животе, он ничего не показывает, а вот наблюдающему за процедурой мужу становится плохо. Резкая боль в груди и животе — и его тоже госпитализируют. Предварительный диагноз — инфаркт или разрыв аорты — не подтверждается. И врачи думают, что у обоих супругов психосоматика или панические атаки.

Чаще всего отеки у страдающих НАО возникают на руках, ногах, лице, в брюшной полости, а так же в гортани. Отек гортани часто затрудняет поступление воздуха в организм, что может привести к удушью.
House, M.D. / NBCUniversal, 2007
Но что если состояние мужа и жены имеет общие причины? Идея интересная. Какое-либо венерическое заболевание? Но опять все тесты отрицательные. Боли у девушки усиливаются. Их сопровождает острый бред и галлюцинации по поводу отца супруга. После чего она впадает в кому. Магнитно-резонансная томография показывает непонятные подозрительные уплотнения в стволе головного мозга, но для постановки точного диагноза информации недостаточно. Зато у мужа на снимках МРТ головной мозг чистый. Никаких новообразований. И возникает другая проблема — повышенное содержание молочной кислоты — симптом ишемии кишечника. Это значит, что кишки недостаточно снабжается кровью, может начаться их некроз, а вслед за ним и смерть пациента.
Оставим ненадолго нашу пару. Разгадка их болезни ждет нас впереди. Отметим лишь, что диагност, а это был небезызвестный доктор Грегори Хаус, оказался в итоге прав — у обоих одно расстройство.
Пациенты доктора Квинке
Его симптомы известны с древних времен. Даже сам термин, которым оно обозначается, пришел из латинского языка — edema (отек, опухоль). Хотя на самом деле происхождение слова греческое — oídēma (распухание). Как и многие другие болезни, ее открытие приписывают Гиппократу. Чуть позже отек, правда обозначенный другим термином — tumor — сейчас связанным скорее с онкологическими заболеваниями, вошел в знаменитую «тетраду Цельса». Она характеризует любое воспаление. Помимо отека Авл Корнелий Цельс (50 год до нашей эры – 25 год нашей эры) выделял rubor («покраснение»), calor («жар»), dolor («боль»).
Первое задокументированное описание болезни принадлежит врачу из Мантуи Марчелло Донати (1538–1602). В своем знаменитом трактате «De medica historia Mirabili», впервые опубликованном в его родном городе в 1586 году, а затем переизданном в Венеции в 1588 и 1597 годах, он рассказывает об одном знатном молодом человеке. Если он употреблял в пищу яйца, то немедленно его губы и лицо сильно распухали, а кожа покрывалась красными пятнами и сыпью.
Позже в 1777 году схожее описание дал и немец Франц Антон Май из Гейдельберга. Он рассказал о пожилом 62-летнем мужчине, проснувшемся как-то утром с опухшими губами и веками. Постепенно отечность распространилась на все лицо, а затем и носоглотку, вызвав затруднения дыхания. Еще страшнее оказался случай в Ирландии, где в 1843 году врач Роберт Грейвс стал свидетелем, как всего за полчаса на лбу его пациента выросла огромная опухоль, а затем расползлась по лицу и вглубь, захватив язык, небо и язычок.
Однако всю славу первооткрывателя болезни получил немецкий доктор Генрих Иренеус Квинке. В 1882 году он вел практику при Кильском университете имени Кристиана Альбрехта, где к нему поступило 14 пациентов со схожими симптомами. У всех наблюдался острый рецидивирующий отек кожи, подкожной клетчатки и слизистых оболочек. Ученик Квинке Ойген Динкельлакер защитил на основе клинических случаев своего учителя диссертацию, в которой навсегда ввел в оборот название «отек Квинке». Спустя три года Пауль Штрюбинг предположил потенциальную связь между нервной системой и процессом формирования отека Квинке. Закрепились и такие термины, как ангионевротический отек и ангиоэдема.
Эхо отцов
Но вернемся в больницу Принстон Плейнсборо. Подозревая некроз кишечника у молодого супруга, врачи делают ему операцию, чтобы удалить отмершие ткани, однако обнаруживают лишь отек. Доктор Хаус отбрасывает свою первоначальную идею об общем заболевании у обоих молодых людей, предполагая васкулит у девушки и порфирию у парня. Но потом обращает внимание на тот факт, что отец белого парня запрещал ему жениться на мулатке, из-за чего они даже повздорили. И… догадывается, что они на самом деле сводные брат и сестра — у них общий отец, а значит это может быть действительно одно заболевание на двоих — редкое и наследственное. Решение найдено — у обоих наследственный ангионевротический отек (НАО).
Какое-то время считалось, что отек Квинке вызывается исключительно внешними факторами, главным образом пищевой аллергией, пока в 1888 году «отец современной медицины» сэр Уильям Ослер (1849–1919) не обратил внимание на записи о внезапных смертях от удушья в пяти поколениях одной семьи. Во всех случаях это был отек носоглотки и горла, затрудняющий дыхание и приводящий к летальному исходу.
У самого юного члена этого клана — 24-летней девушки, Ослер обнаружил регулярно повторяющиеся эпизоды непереносимого распухания различных частей тела, длящиеся от одного до четырех дней. Самые сильные приступы сопровождались сильными болями в животе, тошнотой и рвотой. Всего в роду такие же случаи были зафиксированы у 28 ее родственников — от прапрадедов до кузенов.
Ослер сделал первое исчерпывающее описание симптомов наследственного ангионевротического отека: локализованные в разных частях тела отеки, неизменно сопровождающие их желудочно-кишечные расстройства и ярко выраженный наследственный характер.
Генетическая природа заболевания находила все новые и новые подтверждения: в 1909 была поднята семейная история другого древнего английского рода. В нем на протяжении семи поколений от удушья из-за отека гортани умерло 49 человек. В 1917-м на волне успехов первых генетиков Краудер и Краудер предположили аутосомно-доминантное наследование ангионевротического отека.
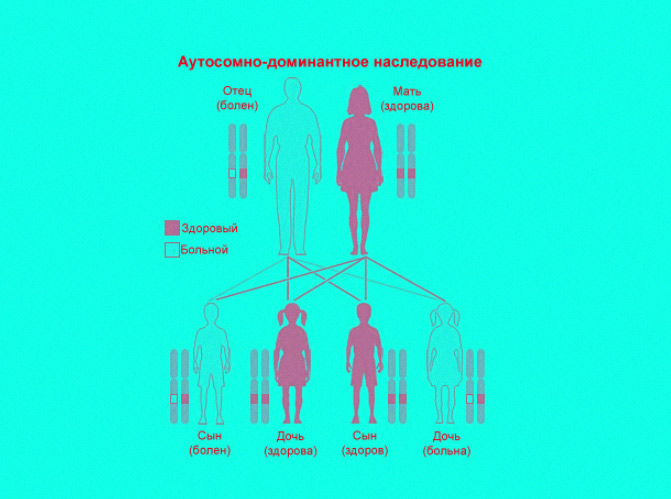
При таком типе наследования ангионевротический отек проявляется в том случае, если у одного из родителей есть хотя бы один соответствующий ей доминантный аллель (вариант) «дефектного» гена, причем этот ген не содержится в половых хромосомах (Х и Y). Генетический дефект может быть унаследован от любого из родителей. Мальчики и девочки болеют с одинаковой частотой.
Таким образом если в паре у одного из родителей имеется мутация, приводящая к ангиоэдеме, то с вероятностью 50 процентов у них будет ребенок, унаследовавший это заболевание. А если «дефектный» ген есть у обоих супругов, как у описанных выше молодоженов, то их малыш с 75-процентной вероятностью унаследует расстройство матери и отца.
У наследственного ангионевротического отека существует три основных типа. Об их особенностях мы расскажем ниже, а сейчас лишь отметим, что типы I и II вызываются мутациями в гене SERPING1. Два этих типа покрывают 99 процентов всех случаев заболеваний. Тип III стал известен лишь недавно и его распространенность пока остается неизвестной, но уже установлено, что он связан с мутациями в гене F12.
Молекулярные сбои
Новый всплеск интереса к наследственному ангионевротическому отеку появился вслед за развитием биохимии в 1960-х годах. Уже в 1961 году Ирвин Липоу, патолог из Кливленда, штат Огайо (США) обнаружил особый белок — естественный ингибитор протеазы. Простыми словами, этот белок препятствовал работе ферментов, помогающих расщеплять другие белки. Ученый назвал его ингибитор С1-эстеразы человека (C1-INH). Впоследствии выяснилось, что это термолабильный — неустойчивый к тепловому воздействию — альфа-глобулин (высокогликолизированный гликопротеин, состоящий из 478 аминокислот).
Данный белок вырабатывался в печени, а обнаруживался в сыворотке крови. Оказалось, что он специфически и исключительно подавляет активность протеаз С1r и C1s-субкомпонентов системы комплемента человека — так называют комплекс защитных белков в крови, реализующих иммунный ответ организма в случае вторжения чужеродных агентов. Если ингибитор C1-INH по каким-либо причинам перестает работать и держать иммунитет в узде, то иммунный ответ выходит из под контроля и может нанести вред самому организму.

В тяжелых случаях отек может разрастаться на горло живот, грудь и даже мозг.
House, M.D. / NBCUniversal, 2007
В феврале 1961 года Натаниэль Ландерман представил в Американской академии аллергии, астмы и иммунологии (American Academy of Allergy, Asthma, and Immunology) свои наблюдения за группой пациентов с наследственным ангионевротическим отеком из армейского госпиталя Уолтера Рида в Вашингтоне, округ Колумбия (США). Ландерман указал на симптомы и предложил алгоритм дифференциального диагноза наследственной ангиоэдемы, а также предложил критерии, позволяющие отличать аллергический отек Квинке от неаллергенного.
Согласно Ландерману, аллергический отек всегда связан с воздействием внешних факторов. Его легко купировать антигистаминными препаратами, он быстро регрессирует и ему редко предшествует продромальные симптомы — ранние предвестники заболевания. Также Ландерман отметил крайнюю опасность наследственного ангионевротического отека — из 358 известных ему случаев, 92 пациента погибли из-за отека гортани и последующей асфиксии.
В 1965 году тайна болезни была окончательно раскрыта Вирджинией Дональдсон и Фредом Розеном, изучившими белковый профиль сыворотки крови большой выборки больных наследственным ангионевротическим отеком. Они обнаружили, что у большинства пациентов уровень ингибитора С1-эстеразы человека (C1-INH) нормальный или даже повышенный, но сам белок функционально не активный.
В последовавшие два десятилетия были установлены и биохимические пути, ведущие к развитию заболевания. Выяснилось, что ключевую роль посредника в развитии отека играют кинины — биологически активные вещества, которые при отсутствии должного контроля значительно повышают проницаемость кровеносных сосудов и вызывают спазмы гладкой мускулатуры в желудочно-кишечном тракте.
К концу XX века на волне исследований препаратов против гипертонии, таких как ингибиторы ангиотензинпревращающего фермента (АПФ), стало понятно, что важнейшим в развитии отека кинином является брадикинин. Дело в том, что АПФ идентичен ферменту кининазе, ответственному за разрушение брадикинина в организме. В ряде случаев прием препаратов против повышенного давления приводил к медикаментозно вызванному ангионевротическому отеку, так как брадикинин — мощнейший вазодилататор, расширяющий сосуды и повышающий их проницаемость, особенно в глубоких слоях кожи и под слизистой оболочкой, что и вызывает сильный, непроходящий отек.
Третий тип
В настоящее время известно три основных типа наследственного ангионевротического отека. Первые два связаны с мутациями в гене SERPING1. Одна из мутаций вызывает значительное снижение содержания белка-ингибитора С1-эстеразы (C1-INH) в плазме крови человека, что и приводит к заболеванию по первому типу. Другая мутация связана с дисфункциональной формой белка C1-INH и ответственна за расстройство второго типа.
Оба варианта известны уже почти 80 лет. А вот третий тип был открыт только в 2000 году. До недавнего времени считалось, что он встречается только у женщин, однако в последнее время были выявлены семьи, где его диагностировали и у мужчин.

Одна из самых серьезных опасностей распространения отека — гиперкапническая кома, за которой может последовать смерть.
House, M.D. / NBCUniversal, 2007
Тип III связан с мутациями в гене F12, который кодирует фактор свертывания крови XII (фактор Хагемана). Это уже бета-глобулин, профермент из группы протеаз. При третьем типе отека концентрация ингибитора С1-эстеразы в плазме крови остается нормальной, поэтому механизм развития заболевания пока так доподлинно и неизвестен, но, вероятно, он никак не связан с C1-INH.
При третьем типе также наблюдается перепроизводство брадикинина в организме. Недавно было обнаружено, что и уровень ингибитора активации плазминогена-2 у пациентов с этим расстройством также очень высок. Возможно, существует связь между избыточным процессом фибринолиза — растворения тромбов и сгустков крови — и активации выработки брадикинина.
Усмирение иммунитета
Ну что же, диагноз супругам — сводной сестре-мулатке и ее белокожему брату-мужу поставлен. Грегори Хаус не без ошибок и ложных ходов, но все же выполнили свою главную задачу. Теперь вопрос — как спасти молодоженам жизнь. Чем лечить столь редкое и неординарное заболевание?
С конца 1960-х годов активно развивались три метода лечения. Во-первых, прием андрогенов (мужских стероидных гормонов). Затем использование антифибринолитиков, которые не только препятствуют лизированию фибриновых сгустков, но и являются ингибитором кининов и некоторых факторов системы комплемента человека. И процветающее до сих пор в некоторых странах применение свежезамороженной плазмы как источника С1-INH.
В настоящий момент аттенуированные андрогены — синтетические стероиды в небольших концентрациях — используются главным образом для долгосрочной профилактики наследственного ангионевротического отека, например, такие препараты, как Оксандролон. Начиная с 1970-х описаны десятки случаев успешного применения для лечения ангиоэдемы Даназола (антигонадотропина) и Станозолола (антипрогестина).
Среди фибринолитиков уже почти 50 лет популярно использование транексамовой кислоты. Однако сейчас в большинстве стран ее исключают из стандартных протоколов лечения, в связи с низкой эффективностью по сравнению с более современными препаратами.
Так как ингибитор C1-эстеразы обычно синтезируется в печени, клетках-моноцитах и фибробластах кожи, а его наивысшая концентрация достигается в плазме крови, то сразу же после признания его центральной роли в патогенезе наследственного ангионевротического отека начались первые попытки выделения этого белка из сыворотки крови здоровых людей. Первые попытки использовать выделенный C1-INH для заместительной терапии и купирования острых приступов ангиоотека описаны еще в 1973 году. Было установлено, что период полураспада этого белка у пациентов составляет 67,7 часов. Получив столь обнадеживающие данные, фарминдустрия создала в 1979 году препарат Беринерт, использующийся и по сию пору. В настоящий момент разработано еще несколько более современных лекарственных средств на основе выделенного из плазмы крови C1-INH: Cetor, Cinryze. А также на основе генетически модифицированного молока кроликов — Rucones.
Впрочем, фарминдустрия не стоит на месте. Сейчас наиболее эффективными считаются таргетные препараты. Одни из них направлены на кинин-калликреиновую систему и препятствуют выработке брадикининов. Например, экаллантид, одобренный американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration, FDA) в 2009 году.
Его эффект основан на блокировании активности калликреина в плазме крови. Как результат, этот белок не воздействует на другой белок — кининоген, а он не запускает выработку брадикинина. В итоге наступающий брадикининовый шторм прерывается, не успев даже начаться. Сосуды сохраняют низкую проницаемость и отек тканей не происходит.
Другая группа препаратов похожа по своей структуре на естественный брадикинин. Они присоединяются к брадикининовым рецепторам клеток, таким как BKRB2, и не дают «правильным» молекулам этого вещества возыметь свое действие на клетки. Наиболее известный препарат такого класса — Икатибант. Благодаря тому, что он блокирует рецепторы ACE в клетках, некоторые врачи сейчас предлагают использовать его и для лечения COVID-19.
Быстрые тесты
Помимо лечения важна и быстрая диагностика. Ведь не везде есть такие специалисты (пусть и вымышленные), как доктор Хаус. Настоящий прорыв на этом фронте случился совсем недавно, благодаря разработкам компании Takeda Pharmaceuticals. Их биохимики предложили тест на количество и активность белков C1-INH по одной сухой капле крови (Dried blood spot testing).
Как следует из названия, для теста используется лишь одна капля сухой крови. У такого подхода масса преимуществ: достаточно лишь небольшого объема крови от укола пальца или пятки (у младенцев), а хранить и транспортировать подобный препарат легко и необременительно.
Исследователи производили экстракцию белка C1-INH из 3 мм крови в капле. Далее в пробу добавляли фиксированное, точно известное количество С1-эстеразы человека и смешивали с хромогенным субстратом. Так как С1-эстераза эффективно расщепляет хромогенный субстрат, а ингибитор C1-INH подавляет ее активность, то зная начальное количество С1-эстеразы и применив метод жидкостной хроматографии и тандемной масс-спектрометрии, можно было установить — сколько функционально активного белка C1-INH содержится в крови. Полученный результат затем сравнивается со стандартным значением.
Новый тест оказался очень надежен. А результаты измерений оставались стабильными как в свежих образцах, так и хранившихся более чем 100 дней с момента взятия (при комнатной температуре). Клинические испытания теста подтвердили его диагностическую эффективность. В них приняли участие 24 пациента с диагнозом наследственный ангионевротический отек (9 мужчин и 15 женщин) и 103 здоровых испытуемых в качестве контрольной группы.
В контрольной группе уровень функционального C1-ингибитора варьировался от 311 до 1090 мЕД/мл (в среднем 573 мЕД/мл). А у 23/24 человек с наследственной ангиоэдемой эти уровни были ниже 100 мЕД/мл. Единственное отклонение имело значение 152 мЕД/мл.
Вместо заключения
Среди всех орфанных заболеваний наследственному ангионевротическому отеку можно сказать повезло. Хотя этот диагноз и был забыт почти на полстолетия — с 1910-х до 1960-х, затем, на волне интереса к биохимии и разработке препаратов для лечения гипертонии, интерес к нему возродился. Однако производство лекарственных средств для его лечения дело коммерчески невыгодное, так как пациентов крайне мало, а средств на разработку и производство уходит много.
Тем не менее, в связи с тем, что наследственный ангиоотек крайне мучителен и смертельно опасен, ряд фармакологических компаний берут на себя социальную миссию обеспечивать врачей необходимыми лекарствами, диагностическими тестами и разрабатывать новые, более эффективные виды терапии.
Благодаря этому, даже в таких сложных случаях, с каким столкнулся доктор Грегори Хаус в клинике Принстон Плейнсборо, ему удалось не только поставить диагноз, но и спасти незадачливых молодоженов, одураченных любовью.
Даниил Кузнецов
Отправьте нам запрос
Поиск на сайте
Наши клиенты и партнеры
Недавние публикации
- В скелете вымершего псового с патагонского погребения заподозрили останки питомца индейцев 16 апреля 2024
- Что нужно для развития в России технологий ИИ, обсудили на форуме «Открытые инновации» 16 апреля 2024
- На снимках солнечного затмения заметили огромное розовое пламя 15 апреля 2024
- Найден источник крупнейшей после Большого взрыва вспышки в космосе 12 апреля 2024
- Формирование визуомоторных ассоциаций оказалось зависимо от мозжечка 12 апреля 2024
